El enlace intermolecular es la unión que como resultado de las fuerzas de carácter electrostático que se establecen entre las moléculas, consigue mantenerlas unidas en una red cristalina.
Aunque hay diferentes tipos de fuerzas intermoleculares, tal como se muestra a continuación, todas ellas tienen mucha menor fortaleza que un enlace iónico o covalente
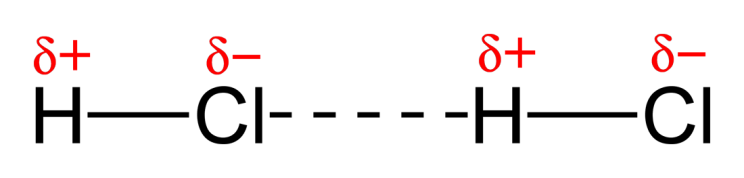
Enlace de hidrógeno: Enlace que se establece entre un átomo de H de una molécula, que por ir unido a F, O ó N (los 3 átomos más electronegativos) tiene una gran densidad de carga positiva, y un átomo de F, O ó N de otra molécula que tendrá una gran densidad de carga negativa:
Fuerzas de Van der Waals:
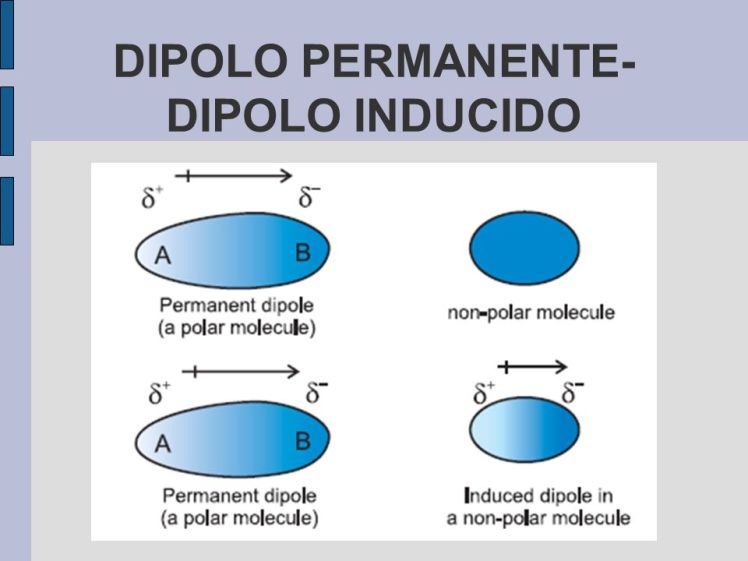
Dipolo permanente – dipolo permanente
(Polar- Polar)
Dipolo permanente – dipolo inducido
(Polar- Apolar)
Dipolo instantáneo – dipolo inducido (fuerzas de dispersión)
(Apolar- Apolar)
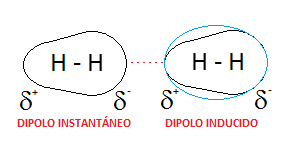
Una molécula no polar puede experimentar un ligero desplazamiento de su nube electrónica y formar un dipolo instantáneo, que induce otro dipolo en una molécula próxima. Ambos dipolos se atraen.
Dentro de cada tipo de Fuerza de Van der Waals, la intensidad aumenta con la superficie de la molécula; es decir, con el tamaño (que en general, aunque no siempre, va unido al peso molecular).
ENLACE QUIMICO INTERATOMICO
Un enlace es la unión entre los átomos de un compuesto. La unión o enlace entre los átomos tiene su origen en la estructura electrónica de los mismos. La actividad química de los elementos radica en su tendencia a adquirir, mediante su unión con otros átomos, la configuración de gas noble (ocho electrones en la capa más externa, salvo el hidrógeno que sólo puede tender al He completándose con dos electrones), que es muy estable. Es corriente distinguir tres tipos principales de enlaces químicos:
- Iónico
- Covalentes
- Metálico
Aunque dichos enlaces tienen propiedades bien definidas, la clasificación no es rigurosa, existiendo una transición gradual de uno a otro, lo que permite considerar tipos de enlace intermedios. Gracias a estos enlaces se forman los compuestos químicos, por ejemplo la sal.
La sal común (cloruro de sodio) es una sustancia bien conocida. Es utilizada para conservar y aderezar alimentos. Nuestra sangre posee casi la misma proporción de sal que el agua del mar, y es fundamental para mantener muchas de nuestras funciones vitales. Está formada por un no metal, el cloro y un metal alcalino, el sodio. Ambos en estado puro son extremadamente peligrosos para el hombre, sin embargo, forman juntas una sustancia, la sal común, que es inocua en pequeñas cantidades. Se dice por tanto que han formado un compuesto químico, una sustancia muy diferente de los elementos que la componen.
Muchas de las sustancias que conocemos están formadas por uniones de distintos elementos. El azúcar, por ejemplo, está formado por oxígeno, hidrógeno y carbono. Estos átomos que pierden o ganan electrones para unirse se transforman en iones, átomos con carga eléctrica. Estos iones se unen para formar compuestos químicos, y la forma de unirse entre ellos se denomina enlace químico, del cual se va a hablar en este trabajo.
Los átomos se unen entre sí para formar moléculas mediante fuerzas de enlace. Los tipos fundamentales de enlace son el iónico, el covalente y el metálico.
1. ENLACE IONICO
El enlace iónico consiste en la atracción electrostática entre átomos con cargas eléctricas de signo contrario. Este tipo de enlace se establece entre átomos de elementos poco electronegativos con los de elementos muy electronegativos. Es necesario que uno de los elementos pueda ganar electrones y el otro perderlo, y como se ha dicho anteriormente este tipo de enlace se suele producir entre un no metal (electronegativo) y un metal (electropositivo). Son elementos distantes en la TP.
Un ejemplo de sustancia con enlace iónico es el cloruro sódico. En su formación tiene lugar la transferencia de un electrón del átomo de sodio al átomo de cloro. Las configuraciones electrónicas de estos elementos después del proceso de ionización son muy importantes, ya que lo dos han conseguido la configuración externa correspondiente a los gases nobles, ganando los átomos en estabilidad. Se produce una transferencia electrónica, cuyo déficit se cubre sobradamente con la energía que se libera al agruparse los iones formados en una red cristalina. Es una red con forma de cubo en la que en los vértices alternan iones Cl– y Na+. De esta forma cada ión Cl– queda rodeado de seis iones Na+ y viceversa.
Propiedades de los compuestos iónicos
Las sustancias iónicas están constituidas por iones ordenados en el retículo cristalino; las fuerzas que mantienen esta ordenación son fuerzas electrostáticas muy intensas. Por esto las sustancias iónicas son sólidos cristalinos con puntos de fusión y ebullición elevados.
No hay coincidencia entre el centro de gravedad de las cargas positivas y el de las negativas: la molécula es un dipolo, es decir, un conjunto de dos cargas iguales en valor absoluto pero de distinto signo, separadas a una cierta distancia. Los dipolos (moléculas polares) tienen las cargas polarizadas dentro de la molécula.
Cuando un compuesto iónico se introduce en un disolvente polar, los iones de la superficie de cristal provocan a su alrededor una orientación de las moléculas dipolares, que enfrentan hacia cada ion sus extremos con carga opuesta a la del mismo. En este proceso de orientación se libera una energía que, arranca al ion de la red. Una vez arrancado, el ion se rodea de moléculas de disolvente: queda solvatado. Las moléculas de disolvente alrededor de los iones se comportan como capas protectoras que impiden la reagrupación de los mismos. El sólido iónico está entonces disuelto. Todo esto hace que, en general, los compuestos iónicos sean solubles en disolventes polares. Así, un compuesto como el NaCl.
2. ENLACE COVALENTE
Lewis expuso la teoría de que todos los elementos tienen tendencia a conseguir configuración electrónica de gas noble (8 electrones en la última capa). Elementos situados a la derecha de la tabla periódica (no metales) consiguen dicha configuración por captura de electrones; elementos situados a la izquierda y en el centro de la tabla (metales), la consiguen por pérdida de electrones. De esta forma la combinación de un metal con un no metal se hace por enlace iónico; pero la combinación de no metales entre sí no puede tener lugar mediante este proceso de transferencia de electrones; por lo que Lewis supuso que debían compartirlos.
Es posible también la formación de enlaces múltiples, o sea, la compartición de más de un par de electrones por una pareja de átomos. En otros casos, el par compartido es aportado por sólo uno de los átomos, formándose entonces un enlace que se llama coordinado o dativo. Se han encontrado compuestos covalentes en donde no se cumple la regla. Por ejemplo, en BCl3, el átomo de boro tiene seis electrones en la última capa, y en SF6, el átomo de azufre consigue hasta doce electrones. Esto hace que actualmente se piense que lo característico del enlace covalente es la formación de pares electrónicos compartidos, independientemente de su número.
Fuerzas intermoleculares
A diferencia que sucede con los compuestos iónicos, en las sustancias covalentes existen moléculas individualizadas. Entre estas moléculas se dan fuerzas de cohesión o de Van der Waals, que debido a su debilidad, no pueden considerarse ya como fuerzas de enlace. Hay varios tipos de interacciones: Fuerzas de orientación (aparecen entre moléculas con momento dipolar diferente), fuerzas de inducción (ion o dipolo permanente producen en una molécula apolar una separación de cargas por el fenómeno de inducción electrostática) y fuerzas de dispersión (aparecen en tres moléculas apolares).
Propiedades de los compuestos covalentes
Las fuerzas de Van der Waals pueden llegar a mantener ordenaciones cristalinas, pero los puntos de fusión de las sustancias covalentes son siempre bajos, ya que la agitación térmica domina, ya a temperaturas bajas, sobre las débiles fuerzas de cohesión. La mayor parte de las sustancias covalentes, a temperatura ambiente, son gases o líquidos de punto de ebullición bajo (ejem.: agua). En cuanto a la solubilidad, puede decirse que, en general, las sustancias covalentes son solubles en disolventes apolares y no lo son en disolventes polares. Se conocen algunos sólidos covalentes prácticamente infusibles e insolubles, que son excepción al comportamiento general descrito. Un ejemplo de ellos es el diamante. La gran estabilidad de estas redes cristalinas se debe a que los átomos que las forman están unidos entre sí mediante enlaces covalentes. Para deshacer la red es necesario romper estos enlaces, los cual consume enormes cantidades de energía
3. ELECTROVALENCIA Y COVALENCIA
Teniendo presenta las teorías de los enlaces iónicos y covalentes, es posible deducir la valencia de un elemento cualquiera a partir de su configuración electrónica.
. La electrovalencia, valencia en la formación de compuestos iónicos, es el número de electrones que el átomo tiene que ganar o perder para conseguir la configuración de los gases nobles.
- La covalencia, número de enlaces covalentes que puede formar un átomo, es el número de electrones desapareados que tiene dicho átomo. Hay que tener presente que un átomo puede desaparecer sus electrones al máximo siempre que para ello no haya de pasar ningún electrón a un nivel energético superior.
4. ENLACE METALICO
Los elementos metálicos sin combinar forman redes cristalinas con elevado índice de coordinación. Hay tres tipos de red cristalina metálica: cúbica centrada en las caras, con coordinación doce; cúbica centrada en el cuerpo, con coordinación ocho, y hexagonal compacta, con coordinación doce. Sin embargo, el número de electrones de valencia de cualquier átomo metálico es pequeño, en todo caso inferior al número de átomos que rodean a un dado, por lo cual no es posible suponer el establecimiento de tantos enlaces covalentes.
En el enlace metálico, los átomos se transforman en iones y electrones, en lugar de pasar a un átomo adyacente, se desplazan alrededor de muchos átomos. Intuitivamente, la red cristalina metálica puede considerarse formada por una serie de átomos alrededor de los cuales los electrones sueltos forman una nube que mantiene unido al conjunto.
5. POLARIDAD DE LOS ENLACES
En el caso de moléculas formadas por átomos diferentes (heteronucleares), uno de los átomos tendrá mayor electronegatividad que el otro y, en consecuencia, atraerá mas fuertemente hacia sí al par electrónico compartido. El resultado es un desplazamiento de la carga negativa hacia el átomo más electronegativo, quedando entonces el otro con un ligero exceso de carga positiva. Por ejemplo, en la molécula de HCl la mayor electronegatividad del cloro hace que sobre éste aparezca una fracción de carga negativa, mientras que sobre el hidrógeno aparece una positiva de igual valor absoluto. Resulta así una molécula polar, con un enlace intermedio entre el covalente y el iónico.